以下、The gut microbiota: a major player in the toxicity of environmental pollutants? 2016 「腸内細菌による環境汚染物質の解毒」という論文の翻訳です。
腸内細菌による環境汚染物質の解毒① の続きです。
翻訳文責:
一社)化学物質過敏症・対策情報センター
代表理事 上岡みやえ
目次
腸内細菌由来の生体異物代謝酵素
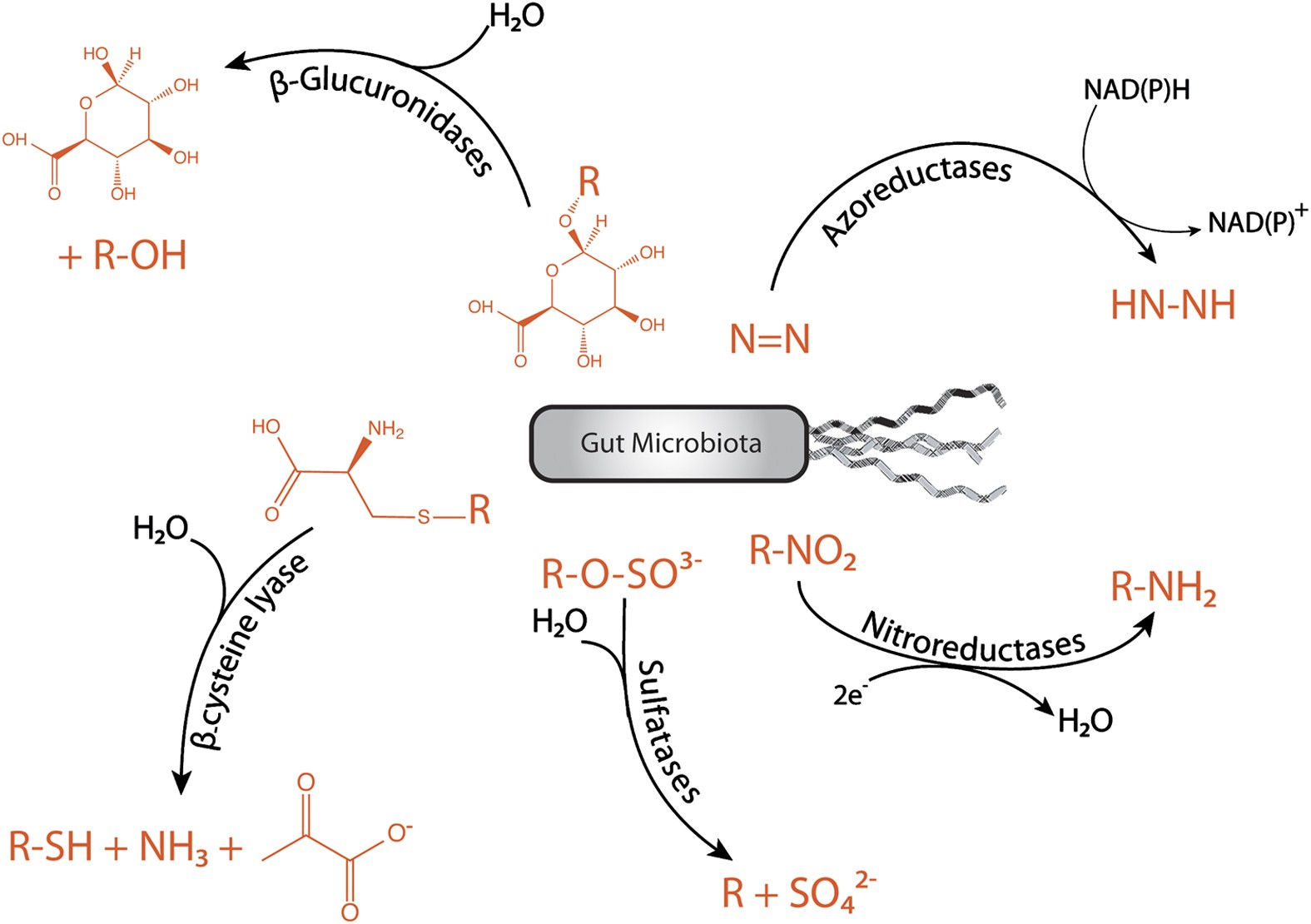
腸内細菌由来の化学反応は多様ですが、腸内細菌由来の生体異物代謝酵素のうち、同定されている酵素ファミリーは、アゾ還元酵素[25,26]、ニトロ還元酵素[27]、β-グルクロニダーゼ[28]、スルファターゼ[29] 、β-リアーゼ[30](図3)などだけです。
腸内細菌由来の生体異物代謝酵素:
(i)アゾ(N = N)結合の還元的開裂は、細菌のアゾ還元酵素によって実行されます。アゾ還元酵素には3つのタイプがあります。
・フラビン依存性NADH優先アゾ還元酵素
・フラビン依存性NADPH優先アゾ還元酵素
・フラビンフリーNADPH優先アゾ還元酵素
(ii)バクテリアのニトロ還元酵素は、ニトロ(–NO2)官能基を対応するアミンに還元します。
細菌由来のニトロ還元酵素には2つのタイプがあります。
・タイプ1:酸素に反応しないニトロ還元酵素が、NAD(P)Hからの電子ペアを追加して、ニトロソ基、ヒドロキシルアミノ、アミノ誘導体を生成することによって、ニトロ基の連続還元を触媒する。
・タイプ2:酸素に反応するニトロ還元酵素が、ニトロ基の単一電子還元を触媒してニトロアニオンラジカルを生成する。
(iii)内因性の硫酸エステルが、細菌由来のスルファターゼによって、消化管内で加水分解される
(iv)生体異物であるグルタチオン抱合体のほとんどは、胆汁中に排泄されます。それらは、哺乳動物固有の酵素(γ-グルタミル-ペプチド転移酵素およびカルボキシペプチダーゼ)によって分解され、システイン抱合体が形成されていきます。システイン抱合体は、β-リアーゼ活性を有する消化管の一部に到達し、対応するチオールに変換される可能性があります。
(v)β-グルクロニダーゼは消化管全体に存在し、胆汁中に排出される生体異物抱合体のなかで最も量の多いグルクロニドの加水分解を促進します。無菌マウスまたは抗生物質で治療したマウスでは、グルクロニドの加水分解量が激減することから(> 90%)、β-グルクロニダーゼの主要な供給源は腸内細菌であると考えられています。
腸内細菌によって代謝される環境化学物質
多環式芳香族炭化水素(PAH)
多環式芳香族炭化水素(PAH)は、炭素含有燃料の不完全な燃焼によって生成され、最も広く存在している有機汚染物質の1つです。タバコの煙、都市の大気汚染物質、ディーゼル排気ガスの他、焼き肉や燻製肉など一部の食品にも含まれています。
多環式芳香族炭化水素(PAH)の毒性は、化学的構造によって異なってきます。エストロゲン特性を持つものの中には、ヒトの発がん性物質が含まれています。
多環式芳香族炭化水素(PAH)へばく露した成人は、肺がんおよび膀胱がんを発症するリスクが高くなります。[31]
Van de Wiele らは、試験管実験によって、ヒトの典型的な腸内細菌によって消化される前と後での、4つの多環式芳香族炭化水素(PAH)(ナフタレン、フェナントレン、ピレン、ベンゾ(a)ピレン)のエストロゲン性を評価しました。[32]
親のPAH分子にはエストロゲン性はありませんでしたが、結腸消化物は、有意なエストロゲン活性を示しました。
ヒドロキシ-PAH、特に1-OHピレンと7-OHベンゾ(a)ピレンは、エストロゲン代謝物として同定されました。
このことは、ヒトの結腸に棲んでいる微生物が、多環式芳香族炭化水素(PAH)をエストロゲン分子に変換し、PAHを生物活性化していることを示唆しています。
さらに、マウスとヒトの腸内細菌は、その肝抱合体からベンゾ(a)ピレンを再生し、毒物学的な関係性がみられる内因性の無害化プロセスを、逆転させうることが示されています[33]。
ニトロ化PAHまたはニトロPAH
ニトロPAHは、PAHのニトロ化によって形成されます。
人間は主に、ディーゼル排ガスと都市の大気汚染物質を吸い込むことで、これらに含まれるニトロPAHにばく露しています。
ニトロPAHは、変異原性、遺伝毒性、および発がん性な、多様な毒性を有しています。
それらは一般に、腸内細菌が大きく関与している人体によって代謝されます[34]。
環境中に存在する、主たるニトロPAHの1つ、 2-ニトロフルオレン(NF)について、ニトロPAHのモデル化合物として説明していきます。
試験管実験では、ヒトの糞便とともに 2-ニトロフルオレン(NF)を培養すると、直接作用型の変異原性が除去されました。[35]
生体実験では、マウスに与えた 2-ニトロフルオレン(NF)は、腸内細菌によって2-アミノフルオレンに還元され、肝臓でアセチル化され、さらにヒドロキシル化されました。
この代謝経路によってヒドロキシル化された 2-アセチルアミノフルオレン が形成されます[36]。量的観点から、最も重要となる代謝経路です。
代替の代謝経路は、直接作用型変異原性の元となるヒドロキシル化ニトロフルオレンの形成をもたらします。
マウスの 2-ニトロフルオレン(NF)代謝を、無菌かどうかによって比較すると、無菌マウスの尿は、通常マウスの尿よりも、変異原性の可能性が6倍高くなっていることが示されました。[36]
この効果は、主に、ヒドロキシル化された 2-ニトロフルオレン(NF)の「存在」と、ヒドロキシル化されたアセチルアミノフルオレンの「不在」によるものであると示唆されています。[36]
つまり、腸内細菌が、 2-ニトロフルオレン(NF)の代謝を通して、変異原性を有する代謝物から宿主を保護しているわけです。
ただし、腸内細菌の有無にかかわらず、2-ニトロフルオレン(NF)がDNA付加体を形成するかどうかを、マウス(通常のマウス/マウスの糞便の懸濁液を与えたマウス/ヒトの糞便の懸濁液を与えたマウス/無菌マウス)で比較すると、無菌マウスでは、DNA付加体は形成されませんでした。
一方、DNA付加体は、腸内細菌を有しているマウスすべての肝臓、結腸上皮、腎臓から検出されました。[35]
DNA付加体の形成は、がん発症における重要な兆候と見なされており、がん発症リスクの生体実験のバイオマーカーとして使用される可能性があります。
2-アセチルアミノフルオレンは、DNA付加体形成を促進することが知られている、強力な発がん物質です。腸内細菌によってDNA付加体が形成されるならば、腸内細菌が、2-ニトロフルオレン(NF)のニトロ還元に関与している可能性があります[37]。
ニトロトルエン
ニトロトルエンは、染料やプラスチックの製造においては重要な中間体です。
2-ニトロトルエンは遺伝毒性があり、2,6-ジニトロトルエンは、マウスでは発がん性(肝臓がん)があります。[38,39]
通常マウスに、標識物質 2,4-ジニトロトルエンを単回経口投与すると、主に4つの代謝物が生成されました。
酸化によって 2,4-ジニトロ安息香酸が、親化合物の酸化とそれに続くグルクロン酸抱合によって 2,4-ジニトロベンジルグルクロニドが、ニトロ還元によって 4-N-アセチル-2-ニトロ安息香酸が、そして酸化によって 2-アミノ-4-ニトロ安息香酸が生成されたのです。
4-N-アセチル-2-ニトロ安息香酸と 2-アミノ-4-ニトロ安息香酸は、無菌マウスではほとんど検出されないことから、腸内細菌が 2,4-ジニトロトルエンのニトロ還元に大きく関与していることが示唆されています[40]。
ヒトの糞便を投与したマウスでも、2,4-ジニトロトルエンが代謝されることが観察されています[41]。
ただし、2-ニトロトルエンおよび2,6-ジニトロトルエンの遺伝毒性は、代謝物の減少ではなく、(ジ)ニトロベンジルアルコールが還元された結果です。腸内細菌は、この毒性発現に大きく関与しています。
2-ニトロトルエン と 2,6-ジニトロトルエン は、ともに小腸で吸収され、肝臓で代謝されて、2-ニトロベンジルアルコール と 2,6-ジニトロベンジルアルコール になります。
これらの化合物は、胆汁に排泄される前にグルクロン酸と結合します。
次に、腸内細菌は、結合したグルクロニドを加水分解し、ニトロ基の一方または両方を還元します。
次に、アミノ誘導体は肝臓で再吸収および酸化され、そこでDNAに共有結合します[39]。
農 薬
除草剤、殺菌剤、殺虫剤、抗菌剤などを総称して農薬と言います。
何千もの異なる化学物質が農薬として使用されており、ヒトの農薬へのばく露は、広範囲に及んでいます。
最も頻繁に使用される化学族は、有機塩素、有機リン、カルバメート、トリアジン、ピレスロイドです。
これらの代謝における、腸内細菌の役割については、ほとんど知られていませんが、いくつかの化学物質が、腸内細菌によって代謝されていることがわかっています。
ジクロロジフェニルトリクロロエタン(DDT)は、現在ほとんどの先進国で禁止されている有機塩素系殺虫剤です。DDT は分解されにくいため、DDT汚染は、いまだ広範囲に及んでいます。
DDT は、さまざまな組織で、エストロゲン活性と抗アンドロゲン活性を示します[42]。
DDT へのばく露は、乳がん、肝臓がん、精巣がん[43] および代謝性疾患の発症リスクを高めます[15]。
DDT は、マウスおよびヒトの糞便によって、ジクロロジフェニル-ジクロロフェニルエタン(DDD)に代謝される可能性があります [44,45]。
生体実験では、DDD は、DDT を胃管経由で投与したマウスから検出されましたが、DDT を腹腔内へ投与したマウスでは検出されませんでした[44]。
このことは、DDT 代謝に腸内細菌が関与している可能性を示すものです。
DDT と DDD は、ともにヒトの内分泌の破壊因子である可能性が高いため、この生体内変化が、生体内活性化に対応するのか、あるいは無毒化に対応するのかは、不明なままです。
プロパクロルは、1998年に製造中止となったアセトアミド系除草剤です。マウスでは、単一部位にプロパクロルを長期間投与すると、プロパクロル誘発性腫瘍が発現します[46]。
プロパクロルは、マウスの腸内細菌によって、親化合物のグルタチオン抱合体とシステイン抱合が胆汁中に排泄された後に代謝されます[47,48]。
グルタチオン抱合体は、肝細胞では、プロパクロルに誘発された細胞毒性からの保護物質です[49]。生体実験中に、腸内細菌による脱抱合が起きた場合には、プロパクロルの毒性が増加すると予想されます。